 Trombofilia ereditară este o condiție complexă care afectează modul în care sângele coagulează, crescând riscul de formare a trombilor (cheaguri de sânge) în vene și artere. Această tendință de a dezvolta tromboză este cauzată de anomalii genetice care afectează sistemul de coagulare al sângelui. Întrucât este o condiție moștenită, riscul de trombofilie poate fi transmis de la părinți la copii. Printre cele mai frecvente tipuri de trombofilii ereditare se numără mutația Factorului V Leiden și deficiențele de proteină C și S.
Trombofilia ereditară este o condiție complexă care afectează modul în care sângele coagulează, crescând riscul de formare a trombilor (cheaguri de sânge) în vene și artere. Această tendință de a dezvolta tromboză este cauzată de anomalii genetice care afectează sistemul de coagulare al sângelui. Întrucât este o condiție moștenită, riscul de trombofilie poate fi transmis de la părinți la copii. Printre cele mai frecvente tipuri de trombofilii ereditare se numără mutația Factorului V Leiden și deficiențele de proteină C și S.
Mutația Factorului V Leiden
Factorul V Leiden este cea mai comună formă de trombofilie ereditară în populațiile de origine europeană. Este cauzată de o mutație în gena Factorului V, care produce o variantă a proteinelor de coagulare ce nu poate fi dezactivată în mod normal de proteina C activată. Această anomalie conduce la o coagulare excesivă a sângelui, crescând semnificativ riscul de tromboză venoasă profundă (TVP), în special în venele picioarelor. Riscul de complicații poate crește în prezența altor factori, cum ar fi sarcina, utilizarea contraceptivelor orale sau imobilitatea prelungită.
Deficiența de Proteină C și S
Proteina C și proteina S sunt două proteine vitale în sistemul natural anticoagulant al organismului. Ele lucrează împreună pentru a preveni coagularea excesivă a sângelui prin inhibarea factorilor de coagulare V și VIII. Deficiența de proteină C sau S poate duce la un deficit al mecanismului de inhibare a coagulării, rezultând într-un risc crescut de formare a cheagurilor de sânge. Acest risc este amplificat în anumite condiții, cum ar fi în timpul sarcinii sau în cazul expunerii la factori de risc specifici, precum fumatul sau sedentarismul.
Mutația Factorului II (Protrombina G20210A)
Mutația Factorului II, cunoscută și ca mutația protrombinei G20210A, este o variantă genetică care duce la niveluri mai ridicate de protrombină în sânge, crescând astfel riscul de tromboză. Aceasta este a doua cea mai frecventă formă de trombofilie ereditară după mutația Factorului V Leiden și poate crește semnificativ riscul de tromboză venoasă profundă, în special în combinație cu alți factori de risc.
Mutația MTHFR
Mutația genei metilentetrahidrofolat reductazei (MTHFR) este o altă condiție genetică care poate influența riscul de trombofilie, deși legătura sa cu tromboza este mai puțin clară decât în cazul altor trombofilii ereditare. Există diferite variante ale mutației MTHFR, dintre care cele mai studiate sunt C677T și A1298C. Aceste mutații pot duce la niveluri crescute de homocisteină în sânge, ceea ce a fost asociat cu un risc crescut de boli cardiovasculare și tromboză.
Inhibitorul Activatorului Plasminogenului de Tip 1 (PAI-1)
PAI-1 este o proteină care joacă un rol în sistemul de fibrinoliză, procesul prin care cheagurile de sânge sunt dizolvate. Nivelele crescute de PAI-1 pot inhiba descompunerea cheagurilor de sânge, crescând astfel riscul de tromboză. Anumite variante genetice în gena PAI-1 pot duce la producția excesivă a acestei proteine.
Anomalii ale Factorului XIII
Factorul XIII este o proteină implicată în stabilizarea cheagului de sânge prin reticularea fibrinei. Anomalii genetice care afectează funcția sau nivelurile Factorului XIII pot influența procesul de coagulare și pot crește riscul de tromboză.
În contextul trombofiliei ereditare, pe lângă mutațiile deja menționate (Factor V Leiden, Factor II [protrombina], MTHFR, PAI-1, deficiențe de proteine C și S, și anomalii ale Factorului XIII), există și alte mutații sau deficiențe genetice care pot afecta coagularea sângelui și pot crește riscul de tromboză. Unele dintre acestea sunt mai puțin comune, dar pot avea implicații semnificative pentru persoanele afectate:
Antitrombina III Deficiență
Deficiența de antitrombină III este o condiție rară, dar gravă, caracterizată printr-o deficiență a unei proteine care inhibă coagularea sângelui. Persoanele cu această deficiență au un risc semnificativ crescut de tromboză venoasă profundă și embolie pulmonară.
Deficiența de Proteina Z
Proteina Z este un cofactor care joacă un rol în inhibarea coagulării sângelui. Deficiența de proteina Z poate crește riscul de tromboză, deși relația exactă și mecanismul prin care se întâmplă acest lucru nu sunt pe deplin înțelese.
Disfibrinogenemie Congenitală
Disfibrinogenemia congenitală este o tulburare rară a coagulării în care fibrinogenul (o proteină esențială pentru formarea cheagurilor de sânge) este prezent la niveluri normale, dar funcționează anormal. Această condiție poate duce atât la sângerare excesivă, cât și la formarea de cheaguri de sânge anormale.
Deficiența de Plasminogen
Deficiența de plasminogen afectează sistemul de fibrinoliză, care este responsabil pentru dizolvarea cheagurilor de sânge. Persoanele cu această deficiență pot experimenta o tendință crescută de formare a cheagurilor de sânge.
Factor V Cambridge, Factor V Hong Kong, și Alte Variante
Există și alte variante ale Factorului V, precum Factor V Cambridge și Factor V Hong Kong, care pot influența coagularea sângelui și pot crește riscul de tromboză, deși acestea sunt mai rare decât mutația Factorului V Leiden.
Factor XII (Hageman Factor) Anomalii
Anomaliile Factorului XII pot influența sistemul de coagulare și fibrinoliza, deși relația exactă dintre mutațiile Factorului XII și tromboza clinică este complexă și încă subiect de cercetare.

Implicații în sarcină
Trombofiliile ereditare pot avea un impact semnificativ asupra sarcinii, crescând riscul de complicații atât pentru mamă, cât și pentru făt. În continuare, voi detalia posibilele complicații și mecanismele lor de producere:
- Tromboza Venosă Profundă (TVP)
TVP se referă la formarea unui cheag de sânge într-o venă profundă, de obicei în picioare. În timpul sarcinii, creșterea nivelurilor de estrogen și presiunea uterului asupra venelor pelvine și ale picioarelor pot încetini fluxul sanguin de întoarcere la inimă, crescând riscul de TVP. Trombofiliile ereditare amplifică acest risc prin predispoziția la coagulare excesivă.
- Embolia Pulmonară (EP)
EP este o complicație gravă a TVP și se produce când un fragment dintr-un cheag se desprinde și călătorește prin circulația sanguină până la plămâni, blocând o arteră. În sarcină, riscul de EP este crescut din aceleași motive ca și TVP, iar trombofiliile ereditare pot accentua acest risc. EP poate fi fatală dacă nu este tratată rapid.
- Complicații Placentare
Trombofiliile pot afecta și circulația sanguină la nivelul placentei, ducând la diverse complicații:
- Preeclampsia: o afecțiune caracterizată prin hipertensiune arterială și prezența proteinelor în urină după săptămâna 20 de sarcină. Trombofiliile pot contribui la disfuncția endotelială, care este un factor implicat în dezvoltarea preeclampsiei.
- Restricția de creștere intrauterină (RCIU): se referă la creșterea insuficientă a fătului din cauza aportului inadecvat de nutrienți și oxigen. Cheagurile de sânge formate din cauza trombofiliei pot restricționa fluxul sanguin în placenta, limitând astfel aportul de nutrienți și oxigen către făt.
- Avort spontan: Trombofiliile pot crește riscul de pierdere a sarcinii, în special în primul trimestru, din cauza formării de cheaguri de sânge în placenta care interferează cu aportul de sânge adecvat către făt.
- Moarte fetală: Similar cu avortul spontan, formarea de cheaguri în placenta poate duce la moarte fetală în trimestrele ulterioare, din cauza insuficienței placentare și a aportului inadecvat de oxigen și nutrienți către făt.
Mecanismele exacte prin care trombofiliile ereditare contribuie la aceste complicații sunt complexe și implică interacțiuni între sistemul de coagulare, circulația sanguină maternă și placentară, și funcția endotelială
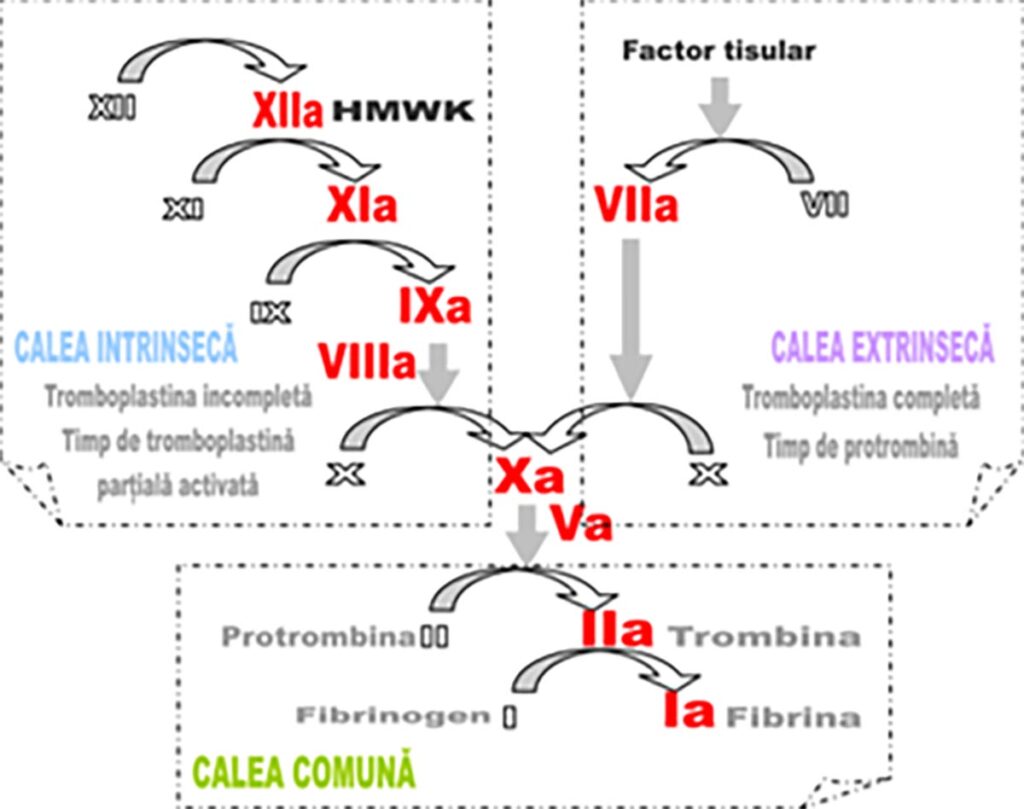
- Coagularea
Trombofiliile ereditare, cum ar fi deficiențele de proteină C și S, mutația Factorului V Leiden, mutația protrombinei G20210A, și altele, cresc tendința sângelui de a coagula. În mod normal, sistemul de coagulare echilibrează nevoia de a forma cheaguri pentru a opri sângerarea cu necesitatea de a menține sângele fluid pentru circulație liberă. Însă, în cazul trombofiliilor, acest echilibru este perturbat, crescând riscul formării cheagurilor în locuri unde pot obstrucționa fluxul sanguin, cum ar fi în venele profunde (riscul de TVP) sau în circulația placentară.
- Circulația materno-placentară
Sarcina induce schimbări fiziologice semnificative în circulația sanguină a mamei, inclusiv creșterea volumului de sânge și modificări ale coagulării pentru a preveni sângerarea excesivă la naștere. Trombofiliile pot exacerba aceste schimbări, crescând riscul de coagulare în placenta sau în vasele de sânge care o alimentează. Astfel, fluxul sanguin adecvat către făt poate fi compromis, afectând aportul de oxigen și nutrienți.
- Endoteliu
Endoteliul, stratul de celule care căptușește interiorul vaselor de sânge, joacă un rol cheie în reglarea coagulării și a fluxului sanguin. Trombofiliile pot afecta funcția endotelială, conducând la o predispoziție către formarea de cheaguri și la disfuncție vasculară. În placenta, aceasta poate duce la dezvoltarea de complicații precum preeclampsia, care este asociată cu disfuncție endotelială și inflamație vasculară, restricție de creștere intrauterină, și în cele din urmă, avort spontan sau moarte fetală din cauza insuficienței placentare.
Impactul interacțiunii dintre aceste sisteme
- Preeclampsia poate fi privită ca rezultat al disfuncției endoteliale și al răspunsului inflamator la placentă, exacerbat de tendința crescută de coagulare din trombofiliile ereditare.
- Restricția de creștere intrauterină (RCIU) și avortul spontan pot rezulta din formarea de cheaguri în circulația placentară, limitând aportul de sânge către făt.
- Moartea fetală poate fi o consecință extremă a insuficienței placentare severe, când fluxul sanguin către făt este semnificativ redus sau blocat.
Diagnosticul și monitorizarea trombofiliei ereditare în timpul sarcinii sunt esențiale pentru gestionarea riscului și prevenirea complicațiilor atât pentru mamă, cât și pentru făt. Procesul implică mai mulți pași și se bazează pe o combinație de evaluări clinice, istoric familial, teste genetice și monitorizare regulată. Iată o detaliere a acestui proces:
Diagnosticul Trombofiliei ereditare
- Evaluare clinică și istoric familial: Primul pas în diagnosticarea trombofiliei ereditare include o evaluare detaliată a istoricului medical personal și familial al pacientei. Medicul va căuta informații despre orice episod anterior de tromboză, pierderi de sarcină repetate, istoricul familial de tromboză sau complicații în sarcini anterioare. Aceste informații pot indica necesitatea unor teste suplimentare.
- Teste genetice și de sânge: Testele genetice specifice sunt esențiale pentru identificarea mutațiilor asociate cu trombofiliile ereditare, cum ar fi Factorul V Leiden, mutația protrombinei G20210A, deficiențele de proteină C și S, și altele. De asemenea, se pot efectua teste de sânge pentru a evalua nivelurile de anticoagulante naturale, cum ar fi antitrombina III, proteină C și S activă, precum și pentru a verifica prezența anticorpilor antifosfolipidici, care pot crește riscul de complicații în sarcină.
Monitorizare în timpul sarcinii
- Evaluări regulate pentru simptomele de tromboză: Femeile diagnosticate cu trombofilie ereditară trebuie monitorizate atent pentru orice semn sau simptom de tromboză venoasă profundă, cum ar fi umflarea, roșeața sau durerea într-unul dintre membre. Detectarea timpurie a simptomelor este crucială pentru intervenția promptă și prevenirea complicațiilor.
- Monitorizarea stării placentare prin ecografie: Monitorizarea placentară este un aspect important în managementul sarcinilor cu risc crescut. Ecografiile pot ajuta la evaluarea fluxului sanguin placentar și uterin, la monitorizarea creșterii fetale și la detectarea oricăror semne de complicații placentare, cum ar fi insuficiența placentară sau restricția de creștere intrauterină. Aceste evaluări pot fi efectuate în mod regulat pe parcursul sarcinii pentru a asigura bunăstarea fătului.
- Consultări cu specialiști: Femeile cu trombofilie ereditară pot necesita consultări regulate cu un specialist în medicină materno-fetală sau un hematolog, pentru a gestiona corespunzător riscurile asociate cu trombofiliile în timpul sarcinii. Acest lucru poate include ajustarea dozelor de medicamente anticoagulante, dacă sunt prescrise, pentru a minimiza riscul de tromboză, păstrând în același timp un echilibru sigur pentru sarcină.
Prin diagnosticul atent și monitorizarea continuă, complicațiile asociate cu trombofiliile ereditare în timpul sarcinii pot fi minimizate, oferind astfel cele mai bune șanse pentru un rezultat favorabil atât pentru mamă, cât și pentru copil.
Analizele recomandate pentru femeile cu trombofilie ereditară în timpul sarcinii joacă un rol crucial în monitorizarea sănătății mamei și a fătului, precum și în prevenirea complicațiilor. În continuare, detaliem fiecare tip de analiză și rolul său:
Teste de coagulare
Testele de coagulare sunt esențiale pentru evaluarea modului în care sângele coagulează și pentru identificarea oricăror anomalii care ar putea crește riscul de formare a trombilor. Printre aceste teste se numără:
- Timpul de protrombină (TP) și INR (International Normalized Ratio): măsoară timpul necesar sângelui pentru a coagula și sunt utilizate pentru monitorizarea tratamentului cu warfarină, deși warfarina este rar utilizată în sarcină din cauza riscurilor asociate fătului.
- Timpul parțial de tromboplastină activată (aPTT): măsoară eficacitatea căilor intrinsecă și comună de coagulare.
- D-dimeri: nivelurile crescute pot indica formarea și descompunerea cheagurilor de sânge, deși acest test are o sensibilitate ridicată dar specificitate scăzută în sarcină datorită faptului că nivelurile de D-dimeri pot fi natural crescute în timpul sarcinii.
Teste genetice pentru mutațiile specifice trombofiliei
Testele genetice sunt utilizate pentru a identifica mutațiile specifice asociate cu trombofiliile ereditare. Acestea includ:
- Mutația Factorului V Leiden și mutația G20210A a protrombinei (Factorul II): cele mai comune forme de trombofilie ereditară.
- Deficiențe de Proteină C, Proteină S, și Antitrombină III: teste care măsoară nivelurile acestor proteine anticoagulante și identifică deficiențele.
- Teste pentru alte mutații, cum ar fi MTHFR (metilentetrahidrofolat reductază), care poate fi asociată cu niveluri crescute de homocisteină în sânge și un risc crescut de complicații în sarcină.
Monitorizare ecografică
Monitorizarea ecografică este fundamentală pentru evaluarea stării placentare și a creșterii fătului. Aceasta include:
- Ecografii Doppler: măsoară fluxul sanguin în arterele uterine, cordonul ombilical și vasele sanguine ale fătului, ajutând la identificarea oricăror semne de restricție a creșterii fătului sau alte probleme circulatorii.
- Ecografii de rutină: urmăresc creșterea și dezvoltarea fătului, evaluând parametri precum dimensiunea fătului, cantitatea de lichid amniotic și poziția placentei.
Aceste teste și monitorizări sunt esențiale pentru gestionarea riscurilor asociate trombofiliilor ereditare în timpul sarcinii. Prin identificarea timpurie a riscurilor și monitorizarea atentă, medicii pot implementa măsuri preventive sau terapeutice pentru a reduce riscul de complicații pentru mamă și făt.
Tratamentul trombofiliilor ereditare în timpul sarcinii se concentrează pe prevenirea complicațiilor asociate, cum ar fi tromboza venoasă profundă (TVP), embolia pulmonară (EP), și complicațiile placentare. Administrația de anticoagulante, în special heparina cu greutate moleculară mică (HGMM), joacă un rol cheie în această abordare. Detaliem mai jos aspectele esențiale ale tratamentului:
Heparina cu greutate moleculară mică (HGMM)
HGMM este preferată în managementul trombofiliei în timpul sarcinii datorită profilului său de siguranță și eficacitate. Iată câteva aspecte importante:
- Siguranță: HGMM nu trece prin placentă și, prin urmare, nu prezintă riscuri pentru făt. Acest lucru o face o opțiune preferabilă în comparație cu anticoagulantele orale, cum ar fi warfarina, care pot cauza malformații congenitale și alte probleme fetale.
- Administrare: HGMM se administrează prin injecții subcutanate, frecvența acestora depinzând de produsul specific și de protocolul de tratament.
- Dozaj: Dozajul de HGMM este individualizat pe baza greutății corporale a pacientei și a riscului specific de tromboză. În unele cazuri, se pot efectua teste de sânge pentru a ajusta dozajul.
Monitorizarea Tratamentului
Deși monitorizarea nivelurilor de anticoagulare nu este de obicei necesară pentru pacienții care primesc HGMM, în anumite situații, cum ar fi insuficiența renală sau la pacienții cu un risc extrem de mare de tromboză, medicii pot decide să monitorizeze activitatea antifactor Xa pentru a ajusta dozajul.
Aspenter (acid acetilsalicilic sau aspirină la doze mici) este adesea utilizat în managementul diferitelor condiții medicale datorită proprietăților sale antiinflamatoare, analgezice, antipiretice și, în special, antitrombotice. În contextul sarcinii și al trombofiliei, aspirina la doze mici poate fi folosită pentru prevenirea complicațiilor specifice, cum ar fi preeclampsia și complicațiile placentare, mai degrabă decât pentru tratamentul direct al trombozei venoase profunde sau al emboliei pulmonare.
Utilizarea în sarcină
- Prevenirea Preeclampsiei: Aspirina la doze mici (de obicei 75-150 mg zilnic) este recomandată pentru femeile cu risc crescut de preeclampsie. Inițierea tratamentului este adesea recomandată în al doilea trimestru de sarcină, pe baza evaluării riscurilor individuale.
- Prevenirea complicațiilor placentare: Studiile sugerează că aspirina la doze mici poate ajuta la îmbunătățirea circulației sanguine placentare și poate reduce riscul de complicații precum restricția de creștere intrauterină (RCIU) și nașterea prematură, în special la femeile cu risc crescut.
Mecanismul de acțiune
Aspirina inhibă irreversibil enzima ciclooxigenază (COX), ceea ce duce la reducerea formării de tromboxan A2, un agent pro-trombotic și vasoconstrictor puternic în plachetele sanguine. Această acțiune reduce agregarea plachetară și îmbunătățește fluxul sanguin, care poate fi benefic în prevenirea complicațiilor sarcinii asociate cu tromboza și disfuncția placentară.
Considerații speciale
Decizia de a începe tratamentul anticoagulant și alegerea dozajului adecvat trebuie să fie întotdeauna personalizate, ținând cont de istoricul medical al pacientei, de riscul specific de tromboză, și de orice alte condiții de sănătate existente. Monitorizarea atentă și colaborarea strânsă cu un specialist în medicină materno-fetală sunt esențiale pentru a asigura atât siguranța mamei, cât și a fătului pe parcursul sarcinii și în perioada postpartum.
Conduita la naștere pentru femeile cu trombofilie ereditară care au fost tratate cu anticoagulante în timpul sarcinii necesită o planificare atentă și individualizată pentru a echilibra riscul de sângerare cu cel de tromboză. Iată câteva principii și considerații cheie:
- Întreruperea anticoagulantelor
- Heparina cu Greutate Moleculară Mică (HGMM): Administrarea HGMM este de obicei întreruptă cu 24 de ore înainte de termenul estimat al nașterii sau al inducției travaliului. Această perioadă poate fi ajustată în funcție de doza folosită și de funcția renală a mamei.
- Anticoagulante orale: Dacă o femeie a fost pe anticoagulante orale (care este rar, datorită riscurilor asociate utilizării lor în timpul sarcinii), acestea trebuie întrerupte și înlocuite cu HGMM sau alte forme de heparină care pot fi mai ușor gestionate înainte de naștere.
- Monitorizarea coagulării
- Este important să se monitorizeze parametrii coagulării în apropierea termenului nașterii pentru a asigura că riscul de sângerare este minimizat. Acest lucru este deosebit de relevant pentru femeile care necesită întreruperea bruscă a anticoagulantelor.
- Planificarea modului de naștere
- Nașterea Vaginală vs. Cezariană: Modul de naștere ar trebui să fie planificat în funcție de indicațiile obstetricale și starea de coagulare. Trombofilia în sine nu este o indicație pentru cezariană, dar alte complicații asociate pot face necesară această abordare.
- Epidurala: Decizia de a folosi anestezie epidurală trebuie luată cu precauție, având în vedere intervalul de timp de la ultima doză de anticoagulant pentru a reduce riscul de hematoma spinală.
- Managementul postpartum
- Reînceperea Anticoagulantelor: Anticoagulantele sunt adesea reîncepute după naștere pentru a reduce riscul crescut de tromboză în perioada postpartum. Momentul reînceperii depinde de evoluția nașterii și de riscul de sângerare.
- Profilaxia Postpartum: Profilaxia extinsă cu HGMM poate fi recomandată pentru 6 săptămâni după naștere pentru femeile cu risc crescut de tromboză.
- Consultare multidisciplinară
- Managementul femeilor cu trombofilie în timpul nașterii ar trebui să implice o echipă multidisciplinară, inclusiv obstetricieni, anesteziști și hematologi, pentru a asigura cea mai sigură abordare pentru mamă și copil.
Planificarea atentă și monitorizarea în perioada peri-nașterii sunt cruciale pentru managementul femeilor cu trombofilie ereditară, pentru a minimiza riscurile atât pentru mamă, cât și pentru nou-născut.
Trombofilia ereditară impune un risc pe termen lung de tromboză, afectând calitatea vieții individului și necesitând o gestionare atentă pentru a minimiza riscurile asociate. Iată câteva aspecte importante legate de efectele pe termen lung și gestionarea riscului:
Modificări ale stilului de viață
- Exercițiul fizic: Activitatea fizică regulată poate îmbunătăți circulația sângelui și reduce riscul de tromboză. Este recomandat să se discute cu un medic despre tipurile de exerciții adecvate.
- Menținerea greutății corporale sănătoase: Obezitatea crește riscul de tromboză, așadar menținerea unei greutăți sănătoase prin dietă și exerciții este importantă.
- Hidratarea: Consumul adecvat de lichide ajută la menținerea vâscozității sângelui în limite normale, reducând riscul de tromboză.
- Evitarea fumatului: Fumatul afectează negativ circulația sângelui și crește riscul de tromboză. Renunțarea la fumat este esențială pentru reducerea acestui risc.
- Limitarea timpului de imobilizare: În timpul călătoriilor lungi sau în alte situații care necesită imobilizare prelungită, este recomandat să se facă pauze regulate pentru a se mișca și a stimula circulația sângelui.
Tratament continuu cu anticoagulante
- Evaluarea periodică: Femeile cu trombofilie ereditară ar trebui să fie evaluate periodic de către un specialist pentru a determina necesitatea continuării tratamentului anticoagulant, în special în situații cu risc crescut, cum ar fi călătoriile lungi, intervențiile chirurgicale sau alte stări de imobilizare.
- Ajustarea tratamentului: Dozajul și tipul de anticoagulant pot necesita ajustări în timp, în funcție de factorii de risc individuali, modificările stilului de viață și alte condiții de sănătate.
Monitorizare și consultații regulate
- Monitorizarea Sănătății: Monitorizarea regulată a stării de sănătate și a factorilor de risc pentru tromboză este crucială. Aceasta poate include teste de sânge periodice și evaluări medicale.
- Consultarea specialiștilor: Este importantă colaborarea strânsă cu specialiști în hematologie, cardiologie și medicină internă pentru o gestionare optimă a riscului pe termen lung.
Planificare familială
- Contracepția: Anumite metode contraceptive, în special cele care conțin estrogen, pot crește riscul de tromboză. Este important ca femeile cu trombofilie ereditară să discute opțiunile de contracepție sigure cu medicul lor.
- Gestionarea sarcinilor viitoare: Riscul de complicații trombotice și placentare poate fi crescut în sarcinile viitoare, necesitând planificare și monitorizare atentă.
Gestionarea trombofiliei ereditare pe termen lung necesită o abordare holistică care include atât modificări ale stilului de viață, cât și, dacă este necesar, tratament medicamentos continuu, toate acestea fiind coordonate de către un specialist. Prevenirea și educația sunt esențiale pentru a reduce riscul de complicații asociate cu această condiție.
